|
|
|
|
|
Galleria Tassonomica
di
Natura Mediterraneo
|
|
|
| Autore |
 Discussione Discussione  |
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 16 luglio 2015 : 18:38:01 Inserito il - 16 luglio 2015 : 18:38:01


|
...poichè il sistema chiede il confronto con unità di misure conosciute,volevo sapere da voi il significato esatto della scala micrometrica,in particolare nella sua parte centrale ma anche in quella periferica.
Ho preso a esempio la foto scattata con l'obiettivo 10x
ciao,grazie
georgios
Immagine:

38,74 KB |
Modificato da - georgios in data 16 luglio 2015 18:39:33 |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 16 luglio 2015 : 20:17:55 Inserito il - 16 luglio 2015 : 20:17:55


|
| ?...non ho capito la domanda...? |
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 16 luglio 2015 : 22:58:21 Inserito il - 16 luglio 2015 : 22:58:21


|
| Messaggio originario di Aphyllo:
?...non ho capito la domanda...?
|
Immagine:

60,4 KB
volevo dire questo: nella calibrazione manuale dove mi si chiede "misurare una distanza conosciuta presente nell’immagine(oculare/vetrino micrometrico)" posso indicare con 10 mµ la distanza tra due tacche. (..come nella foto screen che ho allegato)
ciao
georgios |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 17 luglio 2015 : 02:15:17 Inserito il - 17 luglio 2015 : 02:15:17


|
Certo, per ottenere maggior precisione ti conviene indicare 10 tacche che corrispondono a 100 um, oppure nel 100x forse 5 tacche (50 um)
Se prendi una distanza ragionevolmente grande avrai meno errore. La calibrazione ottenuta la puoi memorizzare, così avrai a disposizione la taratura di ogni obbiettivo senza più usare il vetrino micrometrico.
Ultima cosa: stai attento perche la misurazione che hai effettuato non corrisponde a 10 um ma a molto meno, forse a circa la metà. Infatti se parti misurando dal bordo destro di una tacca devi continuare fino ad un altro bordo destro. La riprova di questo la ottieni confrontando la scala riportata nel bordo superiore del riquadro che deve corrispondere alla misura reale riportata dal vetrino micrometrico |
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 17 luglio 2015 : 22:09:33 Inserito il - 17 luglio 2015 : 22:09:33


|
Mi puoi spiegare per favore i passaggi per la calibrazione automatica?
Grazie, ciao
Georgios
Calibrazione Automatica
Per l’utilizzo di questa funzione è necessario personalizzare il file mycomorpho.ini presente nella
directory d’installazione. Per ogni obiettivo (fino un massimo di 6) devono essere valorizzati due
parametri :
• CalibrazioneXXDescr=descrizione dell’obiettivo
• CalibrazioneXXValue=valore ottenuto dalla divisione della distanza in pixel su la
distanza in micron (si ricorda di utilizzare il punto e non la virgola come separatore
decimale).
• Premere il pulsante “Calibra”
• Utilizzando la combo “Calibrazione” selezionare l’obiettivo utilizzato per la foto
Premere “OK” per confermare
• Viene inserita automaticamente in alto a sinistra una scala graduata in micron e
l’indicazione dell’obiettivo utilizzato. |
Modificato da - georgios in data 17 luglio 2015 22:11:53 |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 17 luglio 2015 : 23:37:22 Inserito il - 17 luglio 2015 : 23:37:22


|
Apri il file .ini con il software "Blocco note"
Selezionalo tutto , fai un copia incolla e incollalo sul prossimo messaggio.
Dopo che l'hai fatto ti darò indicazioni su come compilarlo. La parte della descrizione obbiettivo (Descr) te la compilo io direttamente, un'altra, quella dei valori (Value) relativi ad ogni obbiettivo la compilerai tu in base alle istruzioni che ti darò
|
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 18 luglio 2015 : 00:15:13 Inserito il - 18 luglio 2015 : 00:15:13


|
| Messaggio originario di Aphyllo:
Apri il file .ini con il software "Blocco note"
Selezionalo tutto , fai un copia incolla e incollalo sul prossimo messaggio.
Dopo che l'hai fatto ti darò indicazioni su come compilarlo. La parte della descrizione obbiettivo (Descr) te la compilo io direttamente, un'altra, quella dei valori (Value) relativi ad ogni obbiettivo la compilerai tu in base alle istruzioni che ti darò
|
#MycoMorpho
#Wed Jul 15 20:55:42 CEST 2015
ho trovato solo questo |
Modificato da - georgios in data 18 luglio 2015 00:19:10 |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 18 luglio 2015 : 00:42:03 Inserito il - 18 luglio 2015 : 00:42:03


|
Ok.
Fai copia e incolla di questo
#MycoMorpho
#Wed Jul 15 20:55:42 CEST 2015
Calibrazione01Descr=4x
Calibrazione01Value=
Calibrazione02Descr=10x
Calibrazione02Value=
Calibrazione03Descr=40x
Calibrazione03Value=
Calibrazione04Descr=100x oil
Calibrazione04Value=
Il "value" di ogni obbiettivo lo ottieni facendo la calibrazione manuale.
1) con ImmageJ apri la foto del vetrino micrometrico del primo obbiettivo (4x)
2) Traccia con lo strumento che misura le distanze la distanza di 600 o 800 um
3) Apri Mycomorpho
4) richiedi la calibrazione manuale e riporta nel riquadro apposito la distanza in micron che hai tracciato
5) clicca su "ok"
6) riapri "calibra immagine" e leggi il rapporto "scala attuale di pixel su micron"
7) Scrivi il valore di seguito e nella riga corrispondente al n° dell'obbiettivo (in questo caso: 01)
8) segui lo stesso procedimento per ogni obbiettivo e alla fine fai un copia e incolla nel file .ini di tutto quello che hai scritto, Descr e Value
RICORDATI DI NON LASCIARE SPAZI E DI USARE IL PUNTO (E NON LA VIRGOLA) PER I VALORI DECIMALI |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 18 luglio 2015 : 00:44:10 Inserito il - 18 luglio 2015 : 00:44:10


|
Per farti un esempio, questo sarebbe il mio file .ini
#MycoMorpho
#Sat Apr 26 12:15:07 GMT 2014
Calibrazione06Value=32.2885
PathDati=
Calibrazione03Value=5.165602
Calibrazione04Descr=40x plapo ph2 tubo1.00
Calibrazione01Descr=100 ph an 1.30 tubo 1.00
Calibrazione04Value=12.84983
Calibrazione05Descr=90x pv tubo 1.25
Calibrazione01Value=31.72798
Calibrazione02Descr=63x pv
UltimaCalibrazione=28.468
Calibrazione05Value=36.48728
Calibrazione06Descr=100x plapo tubo 1.00
Calibrazione02Value=24.85358
Calibrazione03Descr=16x tubo 1 vario 1 |
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 18 luglio 2015 : 15:07:00 Inserito il - 18 luglio 2015 : 15:07:00


|
ho fatto come hai detto ed ho ricopiato i valori ottenuti sul file .ini ottenendo i seguenti valori:
#MycoMorpho
#Wed Jul 15 20:55:42 CEST 2015
Calibrazione01Descr=4x
Calibrazione01Value=0.476
Calibrazione02Descr=10x
Calibrazione02Value=1.203
Calibrazione03Descr=40x
Calibrazione03Value=4.870
Calibrazione04Descr=100x oil
Calibrazione04Value=12.120
ciao,grazie
georgios |
Modificato da - georgios in data 18 luglio 2015 15:16:35 |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 18 luglio 2015 : 17:56:58 Inserito il - 18 luglio 2015 : 17:56:58


|
Per avere la sicurezza che non ci siano errori misura con ogni obbiettivo una lunghezza del vetrino micrometrico usando la taratura memorizzata.
Il risultato ovviamente deve coincidere con la lunghezza nota (se non sei strafortunato ovviamente con un piccolo errore che potrà essere al massimo del 2-3%) .... ma probabilmente questo l'avrai già fatto.
Dunque buona microscopia! |
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 18 luglio 2015 : 18:26:20 Inserito il - 18 luglio 2015 : 18:26:20


|
| Messaggio originario di Aphyllo:
Per avere la sicurezza che non ci siano errori misura con ogni obbiettivo una lunghezza del vetrino micrometrico usando la taratura memorizzata.
Il risultato ovviamente deve coincidere con la lunghezza nota (se non sei strafortunato ovviamente con un piccolo errore che potrà essere al massimo del 2-3%) .... ma probabilmente questo l'avrai già fatto.
Dunque buona microscopia!
|
si infatti l'ho già fatto e le misure sembrano proprio coincidere.
Oltre a questo che ho già fatto,mi puoi dire se c'è ancora qualcos'altro da mettere a punto dei passaggi successivi?
grazie,ciao
georgios |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 18 luglio 2015 : 19:41:24 Inserito il - 18 luglio 2015 : 19:41:24


|
Direi di no. Da quel che ho capito hai fatto tutto
In pratica ora apri una immagine con ImmageJ, apri il plugin Mycomorpho, selezioni l'obbiettivo usato dal menù a tendina, tracci e convalidi le misure di lunghezza e larghezza, poi dai l'ok. Se lo fai su più strutture dello stesso tipo, come ad esempio una decina o più di spore, puoi ottenere i vari parametri, copiarli e incollarli per archiviarli in qualsiasi file di testo
Questo è un esempio di una mia misurazione:
Numero campioni =13
Lunghezza Larghezza Q
Min 10,130 4,990 1,930
Media 10,879 5,246 2,075
Max 11,760 5,460 2,300
Varianza 0,310 0,018 0,012
Deviazione Standard 0,557 0,136 0,111
Errore Standard 0,155 0,038 0,031
Curtosi -1,554 -1,186 -0,663
Asimmetria 0,181 -0,169 0,544
Limite di Confidenza Inf 10,576 5,172 2,015
Limite di Confidenza Sup 11,182 5,320 2,135
Indice di Correlazione Lineare = 0,137
Coeffiente di determinazione = 0,019
Indice di Regressione Lineare Y=a+b*X a=7,082 b=0,724
Indice di Regressione Lineare X=a+b*Y a=4,778 b=0,043
IO UTILIZZO LE PRIME QUATTRO RIGHE, FINO A VARIANZA. GLI ALTRI PARAMETRI è ROBA DA STUDIOSI DI STATISTICA. I PARAMETRI DI VARIANZA INVECE TI DANNO VELOCEMENTE UN'IDEA SULLA STABILITà DELLA DIMENSIONE DELLE SPORE (UN VALORE ALTO CORRISPONDE A DIMENSIONI INSTABILI)
C'è ANCHE UNA BELLISSIMA FUNZIONE DI GRAFICO...ALMENO NELLA MIA VERSIONE CHE è LA SUCCESSIVA ALLA TUA. PURTROPPO NON RIESCO A TROVARE IL FILE ZIP DI QUESTA VERSIONE. |
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 19 luglio 2015 : 20:25:32 Inserito il - 19 luglio 2015 : 20:25:32


|
| Messaggio originario di Aphyllo:
Direi di no. Da quel che ho capito hai fatto tutto
In pratica ora apri una immagine con ImmageJ, apri il plugin Mycomorpho, selezioni l'obbiettivo usato dal menù a tendina, tracci e convalidi le misure di lunghezza e larghezza, poi dai l'ok. Se lo fai su più strutture dello stesso tipo, come ad esempio una decina o più di spore, puoi ottenere i vari parametri, copiarli e incollarli per archiviarli in qualsiasi file di testo
Questo è un esempio di una mia misurazione:
Numero campioni =13
Lunghezza Larghezza Q
Min 10,130 4,990 1,930
Media 10,879 5,246 2,075
Max 11,760 5,460 2,300
Varianza 0,310 0,018 0,012
Deviazione Standard 0,557 0,136 0,111
Errore Standard 0,155 0,038 0,031
Curtosi -1,554 -1,186 -0,663
Asimmetria 0,181 -0,169 0,544
Limite di Confidenza Inf 10,576 5,172 2,015
Limite di Confidenza Sup 11,182 5,320 2,135
Indice di Correlazione Lineare = 0,137
Coeffiente di determinazione = 0,019
Indice di Regressione Lineare Y=a+b*X a=7,082 b=0,724
Indice di Regressione Lineare X=a+b*Y a=4,778 b=0,043
IO UTILIZZO LE PRIME QUATTRO RIGHE, FINO A VARIANZA. GLI ALTRI PARAMETRI è ROBA DA STUDIOSI DI STATISTICA. I PARAMETRI DI VARIANZA INVECE TI DANNO VELOCEMENTE UN'IDEA SULLA STABILITà DELLA DIMENSIONE DELLE SPORE (UN VALORE ALTO CORRISPONDE A DIMENSIONI INSTABILI)
C'è ANCHE UNA BELLISSIMA FUNZIONE DI GRAFICO...ALMENO NELLA MIA VERSIONE CHE è LA SUCCESSIVA ALLA TUA. PURTROPPO NON RIESCO A TROVARE IL FILE ZIP DI QUESTA VERSIONE.
|
son riuscito a far le misurazioni (lungh, largh, Q ) e riportarle sulla tabella MycoMorpho,anche se dopo la seconda misurazione mi pare si sovrascrivano i valori sulla tabella stessa.
Adesso che devo fare per ottenere la tabella di misurazione come quella che hai ottenuto tu?
grazie,ciao
georgios |
Modificato da - georgios in data 19 luglio 2015 20:49:23 |
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 19 luglio 2015 : 23:07:39 Inserito il - 19 luglio 2015 : 23:07:39


|
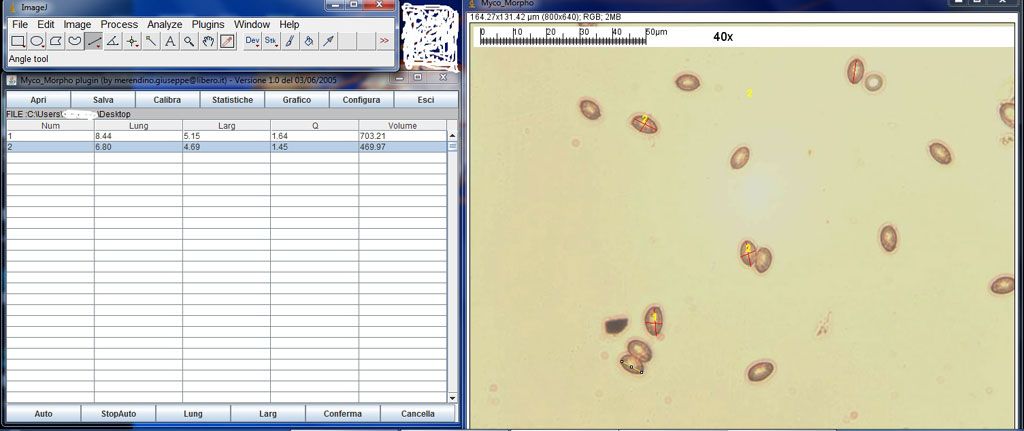
allego uno screen per essere più comprensibile.
Si verifica che ogni misurazione successiva viene sovrascritta, e sostituisce i valori già riportati in casella n. 2
 
Come fare per superare questo ostacolo imprevisto?
ciao,grazie
georgios
Immagine:
69,49 KB
ps: la misurazione è riferita alle spore di cortinarius (v.pagine prec.) |
Modificato da - georgios in data 19 luglio 2015 23:37:14 |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 19 luglio 2015 : 23:57:51 Inserito il - 19 luglio 2015 : 23:57:51


|
| Dopo che hai messo lunghezza e larghezza devi cliccare su "conferma" |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 20 luglio 2015 : 00:00:23 Inserito il - 20 luglio 2015 : 00:00:23


|
| Ora però devi sistemare l'illuminazione per quel difetto dell'alone |
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 20 luglio 2015 : 16:28:47 Inserito il - 20 luglio 2015 : 16:28:47


|
| Messaggio originario di Aphyllo:
Dopo che hai messo lunghezza e larghezza devi cliccare su "conferma"
|
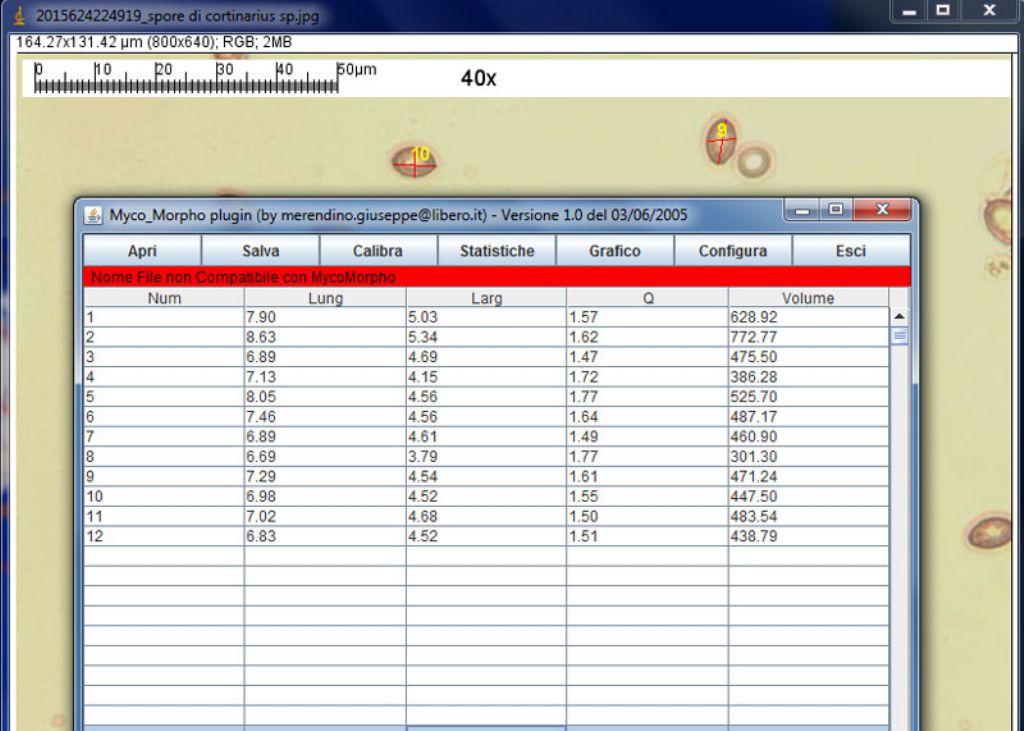
ok,misurate 12 spore.
Scusa Marco,ma ho alcune altre domande:
1) per ottenere una tabella con i parametri come quella tua, devo cliccare su "grafico" o su "statistiche" ?
2)non mi fa salvare la tabella con le misure delle spore ottenute perchè mi scrive " Nome File Non Compatibile con MycoMorpho".
ciao,grazie
georgios
Immagine:
111,86 KB |
Modificato da - georgios in data 20 luglio 2015 16:55:55 |
 |
|
|
Aphyllo
Moderatore
    
Città: firenze
Prov.: Firenze
Regione: Toscana

9113 Messaggi
Micologia |
 Inserito il - 20 luglio 2015 : 16:39:09 Inserito il - 20 luglio 2015 : 16:39:09


|
Per avere i dati di statistiche dovresti cliccare su statistiche, quando invece clicchi su grafico ti dovrebbe comparire l'andamento del lunghezza e della larghezza delle spore che ti dà l'idea della variabilità dei valori.
Per salvare la tabella delle statistiche devi seguire le istruzioni che ti ho mandato in pdf |
 |
|
|
georgios
Utente Junior
 
Città: carbonia
Prov.: Cagliari
Regione: Sardegna

44 Messaggi
Tutti i Forum |
 Inserito il - 21 luglio 2015 : 15:08:33 Inserito il - 21 luglio 2015 : 15:08:33


|
| Messaggio originario di Aphyllo:
Per avere i dati di statistiche dovresti cliccare su statistiche, quando invece clicchi su grafico ti dovrebbe comparire l'andamento del lunghezza e della larghezza delle spore che ti dà l'idea della variabilità dei valori.
Per salvare la tabella delle statistiche devi seguire le istruzioni che ti ho mandato in pdf
|
ho salvato la tabella, di cui al messaggio precedente, come file.csv, ma cliccando sul tasto "Statistiche" o sul tasto "Grafico" non succede niente.
Perche?
grazie,ciao
georgios |
 |
|
 Discussione Discussione  |
|
|
|
 Natura Mediterraneo Natura Mediterraneo |
© 2003-2024 Natura Mediterraneo |
 |
|
Leps.it | Herp.it | Lynkos.net
|

 Forum
|
Registrati
|
Msg attivi
|
Msg Recenti
|
Msg Pvt
|
Utenti
|
Galleria |
Map |
Forum
|
Registrati
|
Msg attivi
|
Msg Recenti
|
Msg Pvt
|
Utenti
|
Galleria |
Map |