| Autore |
 Discussione Discussione  |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 10 dicembre 2017 : 19:07:34 Inserito il - 10 dicembre 2017 : 19:07:34


|
II-III giorno di coltura, myxoamebe (?)
Immagine:
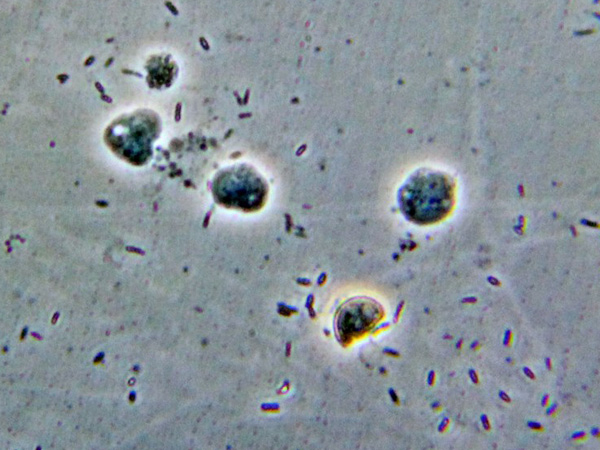
132,85 KB |
|
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 10 dicembre 2017 : 19:08:49 Inserito il - 10 dicembre 2017 : 19:08:49


|
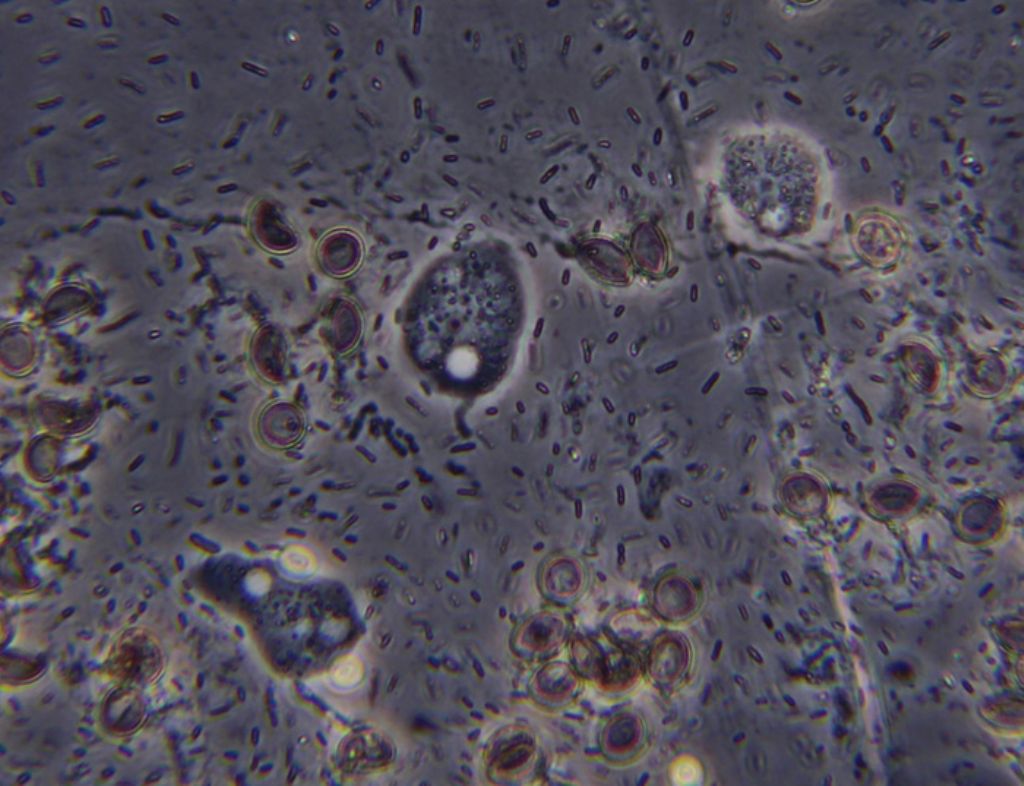
Immagine:
70,25 KB |
|
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 10 dicembre 2017 : 19:17:20 Inserito il - 10 dicembre 2017 : 19:17:20


|
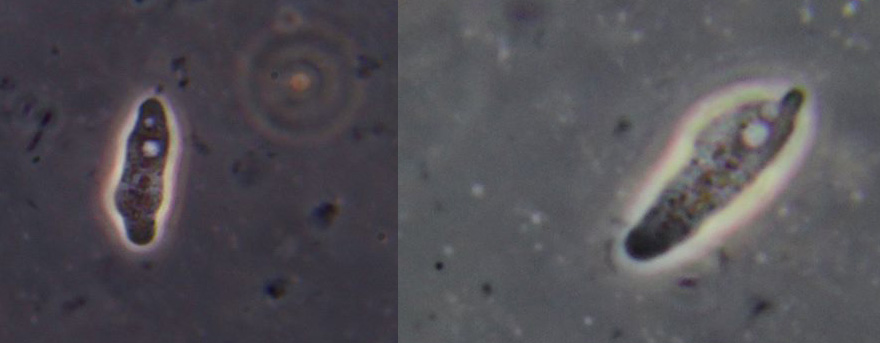
dopo X giorni
zigoti in sviluppo e/o giovani plasmodi?
Immagine:
131,94 KB |
|
Modificato da - pandalf in data 10 dicembre 2017 19:20:50 |
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 10 dicembre 2017 : 19:21:12 Inserito il - 10 dicembre 2017 : 19:21:12


|
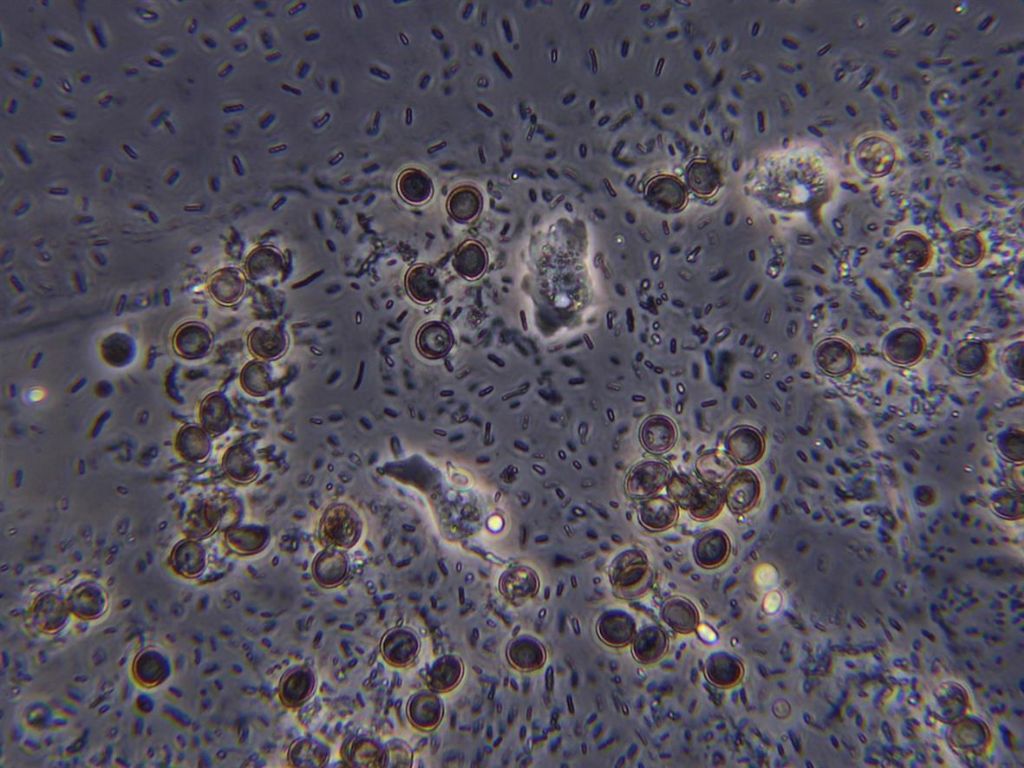
Immagine:
112,48 KB |
|
 |
|
|
danilos
Utente Senior
   

Città: Verona
Regione: Veneto

736 Messaggi
Micologia |
 Inserito il - 10 dicembre 2017 : 19:26:22 Inserito il - 10 dicembre 2017 : 19:26:22


|
ciao Pandalf
sono riuscito anche io a far nascere delle myxoamebe di Physarum e fare dei
video, curioso il modo di locomozione
 |
Danilo |
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 10 dicembre 2017 : 19:32:43 Inserito il - 10 dicembre 2017 : 19:32:43


|
Davvero  tra l'altro sembra che varino alcune abitudini di locomozione in base alla diluizione del substrato o alla specie. Se hai qualche video lo guardo volontieri tra l'altro sembra che varino alcune abitudini di locomozione in base alla diluizione del substrato o alla specie. Se hai qualche video lo guardo volontieri |
|
Modificato da - pandalf in data 10 dicembre 2017 19:38:13 |
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 10 dicembre 2017 : 22:55:10 Inserito il - 10 dicembre 2017 : 22:55:10


|
altra foto fatta adesso dove si vede meglio l'interno:
Immagine:
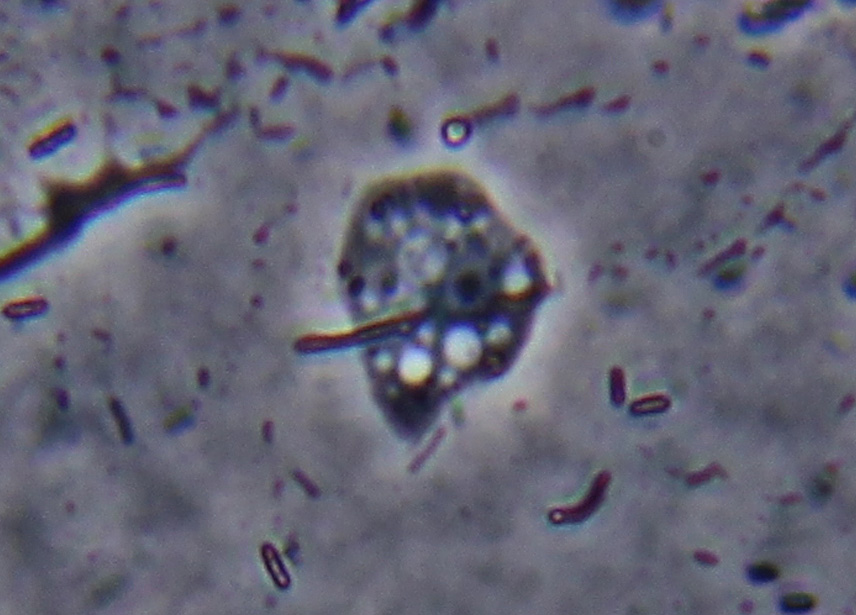
169,7 KB |
|
Modificato da - pandalf in data 10 dicembre 2017 22:57:30 |
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 11 dicembre 2017 : 01:53:56 Inserito il - 11 dicembre 2017 : 01:53:56


|
e questa una foto dove si notano, credo, tutte le fasi viste sopra:
Immagine:
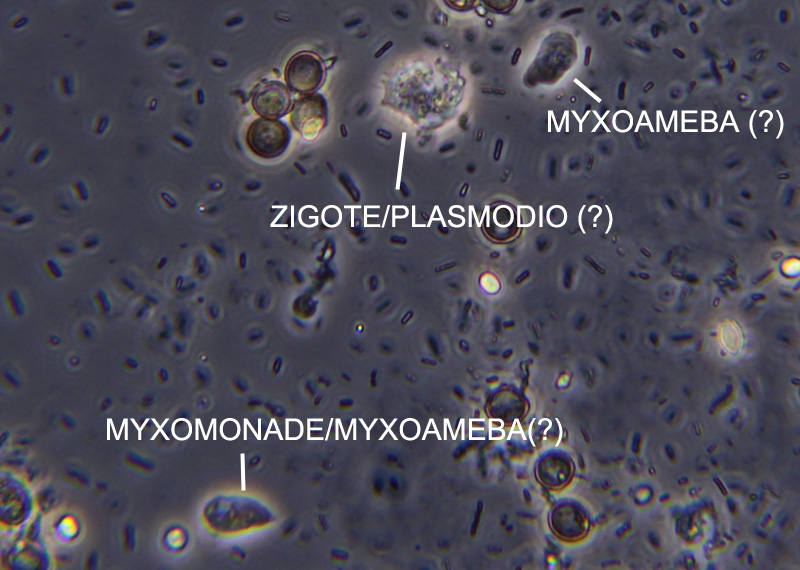
181,85 KB
Quelli che suppongo siano zigoti/giovani plasmodi sono in genere 2-4 volte più grandi delle mixoamebe. Prima di giungere però a osservazioni errate preferirei sentire il vostro parere |
|
Modificato da - pandalf in data 11 dicembre 2017 02:01:03 |
 |
|
|
franco
Utente Senior
   
Città: Trieste
Prov.: Trieste
Regione: Friuli-Venezia Giulia

782 Messaggi
Micologia |
 Inserito il - 11 dicembre 2017 : 07:49:16 Inserito il - 11 dicembre 2017 : 07:49:16


|
cmpimenti, cmpimenti, cmpimenti
mi fai tornare agi anni '80, quando facevo 'ste cose...
se blocchi con formalina al 10%,
riuscirai a vedere il secondo flagello
per lo zigote no, per amebe si
se vuoi capire devi colorare con eosina i nuclei
adesso non ricordo la metodica ma la trovi in rete...
Lo zigote dura poco, è difficile da osservare... persevera
di solito è tondo, sembra una grande spora, non una ameba
un abbraccio virtuale a tutti
scusate la lunga e non ancora finita assenza
spero di ricominciare a presto
|
Franco |
 |
|
|
ul cast
Utente Senior
   
Città: Albizzate
Prov.: Varese
Regione: Lombardia

2947 Messaggi
Tutti i Forum |
 Inserito il - 11 dicembre 2017 : 11:23:40 Inserito il - 11 dicembre 2017 : 11:23:40


|
Molto interessante...
ci dici come procedi, dalla preparazione del substrato alla "semina"?
e a quanti ingrandimenti hai realizzato le foto?  |
|
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 11 dicembre 2017 : 15:59:08 Inserito il - 11 dicembre 2017 : 15:59:08


|
| Messaggio originario di franco:
cmpimenti, cmpimenti, cmpimenti
mi fai tornare agi anni '80, quando facevo 'ste cose...
se blocchi con formalina al 10%,
riuscirai a vedere il secondo flagello
per lo zigote no, per amebe si
se vuoi capire devi colorare con eosina i nuclei
adesso non ricordo la metodica ma la trovi in rete...
Lo zigote dura poco, è difficile da osservare... persevera
di solito è tondo, sembra una grande spora, non una ameba
un abbraccio virtuale a tutti
scusate la lunga e non ancora finita assenza
spero di ricominciare a presto
|
Grazie Franco per queste preziose indicazioni  Eosina dovrei avercela in polvere, se riesco guardo di riuscire a fare qualche foto in campo chiaro o fluorescenza. Eosina dovrei avercela in polvere, se riesco guardo di riuscire a fare qualche foto in campo chiaro o fluorescenza.
A presto
| Molto interessante...
ci dici come procedi, dalla preparazione del substrato alla "semina"? |
Ho seguito l'articolo di coltivazione Link (con qualche piccola variazione) più alcuni links citati nella sua bibliografia. Se ho tempo più tardi scrivo qualche riga sul procedimento, magari anche per qualche consiglio o suggerimento in più (con qualche piccola variazione) più alcuni links citati nella sua bibliografia. Se ho tempo più tardi scrivo qualche riga sul procedimento, magari anche per qualche consiglio o suggerimento in più 
| | e a quanti ingrandimenti hai realizzato le foto? |
uso una canon 60d appoggiata senza tubo adattore e oculare di proiezione allo Zeiss Photomic I, con Optovar impostato a 2 per supperire alla vignettatura e alla diminuzione dell'ingrandimento. L'obbiettivo è uno Zeiss 40x a contrasto di fase.
|
|
Modificato da - pandalf in data 11 dicembre 2017 16:07:57 |
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 11 dicembre 2017 : 18:37:39 Inserito il - 11 dicembre 2017 : 18:37:39


|
Dunque, sperando di far cosa gradita provo a scrivere due righe riguardanti i tentativi di chi si affaccia per la prima volta alla germinazione in agar.
Circa un mesetto fa, esplorando le colline di Scandicci, raccolsi alcune fruttificazioni di Stemonitis axifera ormai secche, con spore formatisi circa 1-2 settimane prima. Dopo le molte prove fallite dello scorso anno mi ero un po' scoraggiato, tuttavia non perdendo la voglia di riprovare. Feci quindi una prima semina in delle provette pulite con acqua di rubinetto o da osmosi bollita (1-2 mm sul fondo): in entrambi i casi ottenevo, dopo qualche giorno, le myxomonadi che però mi morivano tutte nel giro di 2-4 giorni:
Immagine:

41,57 KB |
|
Modificato da - pandalf in data 11 dicembre 2017 18:44:16 |
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 11 dicembre 2017 : 19:12:56 Inserito il - 11 dicembre 2017 : 19:12:56


|
Qualche settimana più tardi, consultando l'articolo di coltivazione di Stemonitis axifera, provai a preparare i substrati in agar (dose standard 6g/l -> 1.2g/100 ml, con diluizione non eccessiva a 0.8-0.9g/100 ml). Le spore sono state aggiunte come consigliato in precedenza da Franco, ovvero lasciandole cadere direttamente dallo sporofito senza che quest'ultimo toccasse il substrato. Il tutto poi coperto da qualche mm d'acqua da osmosi bollita:
Immagine:

84,39 KB
Pure in questo caso ottenni una buona germinazione seguita da un'altrettanto rapida scomparsa di myxomonadi a distanza di pochi giorni. Evidentemente lo sviluppo di ciliati, l'assorbimento dell'acqua superciale senza riaggiunte e lo sviluppo moderato di alcuni funghi avevano avuto la meglio. Arrivai dunque a ipotizzare, forse erroneamente, che non ero capace di controllare lo sviluppo delle poche spore su una superficie così vasta, tanto meno a tenerne sempre un discreto numero in prossimità per poi facilitargli le fasi successive.
Pensai quindi di usare dei test tubes da 12 mm a 20 mm con lo scopo di concentrare le spore e diminuire la superficie eventualmente contaminata dal resto.
|
|
Modificato da - pandalf in data 11 dicembre 2017 19:28:00 |
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 11 dicembre 2017 : 19:36:35 Inserito il - 11 dicembre 2017 : 19:36:35


|
Dopo una passata di alcol all'interno, le provette sono state riempite di una soluzione di agar a 0.1-0.3 g/100 ml + 1-2 mm di acqua da osmosi bollita superficiale. Ho anche provato tuttavia a fare alcune variazioni sul tema come consigliato, tenendo la superficie non coperta o sommersa solo nella parte centrale:
Immagine:

64,88 KB |
|
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 11 dicembre 2017 : 19:37:25 Inserito il - 11 dicembre 2017 : 19:37:25


|
Immagine:

62,54 KB |
|
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 11 dicembre 2017 : 19:49:17 Inserito il - 11 dicembre 2017 : 19:49:17


|
le spore, una volta imbibite, sono germinate in abbondanza e con gran facilità, sebbene con percentuali diverse nei vari test tubes. Ho inoltre riscontrato che alcune colture interessate marginalmente da alcune contaminazioni (pochissimi zigomiceti e un surplus di batteri) sono arrivate più velocemente agli stadi successivi che ho fotografato ieri. Ciò non succedeva nelle piastre di petri, ma già il fatto che rimangano vitali per oltre 10 giorni mi lascia qualche speranza per osservare fasi avanzate per poi spostarle nuovamente sulla piastra.
Immagine:

94,66 KB
test tube con una concentrazione eccessiva di spore, tipica di chi sperimenta per la prima volta.
Spero di imparare a essere più parsimonioso nelle prossime occasioni 
|
|
Modificato da - pandalf in data 11 dicembre 2017 20:15:54 |
 |
|
|
ul cast
Utente Senior
   
Città: Albizzate
Prov.: Varese
Regione: Lombardia

2947 Messaggi
Tutti i Forum |
 Inserito il - 12 dicembre 2017 : 14:55:37 Inserito il - 12 dicembre 2017 : 14:55:37


|
Grazie di nuovo per le delucidazioni 
viene proprio voglia di sperimentare...  |
|
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 13 dicembre 2017 : 00:47:49 Inserito il - 13 dicembre 2017 : 00:47:49


|
| Sicuramente merita sempre provare e riprovare. Già ieri sera, 24 ore dopo da quando tutto andava bene, ho costatato un'apparente moria/scomparsa di massa sia di myxoamebe che di myxomonadi in almeno 9 provette che andavano avanti da 13 giorni. Ho anche provato a osservare l'eventuale presenza di plasmodi sotto micro interrogarmi sulla situazione, ma per ora non ho trovato grandi risposte se non di aspettare qualche altra settimana. |
|
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 13 dicembre 2017 : 01:05:26 Inserito il - 13 dicembre 2017 : 01:05:26


|
Una cosa che potrei fare con le colture ancora più giovani è di prelevare alcune myxoamebe per poi riportarle su nuovo substrato Link . Si tenta, male che vada si sbaglierà imparando qualcosa . Si tenta, male che vada si sbaglierà imparando qualcosa |
|
Modificato da - pandalf in data 13 dicembre 2017 01:09:46 |
 |
|
|
pandalf
Utente V.I.P.
  

398 Messaggi
Tutti i Forum |
 Inserito il - 13 dicembre 2017 : 01:57:26 Inserito il - 13 dicembre 2017 : 01:57:26


|
Qui di seguito alcuni video delle colture al dodicesimo giorno, 15 ore prima dell'apparente tracollo:
Link
Link
Link
|
|
Modificato da - pandalf in data 13 dicembre 2017 02:06:45 |
 |
|
| |
 Discussione Discussione  |
|

 Forum
|
Registrati
|
Msg attivi
|
Msg Recenti
|
Msg Pvt
|
Utenti
|
Galleria |
Map |
Forum
|
Registrati
|
Msg attivi
|
Msg Recenti
|
Msg Pvt
|
Utenti
|
Galleria |
Map |